DIABETUL DE TIP 2 - Partea II
În prima parte a acestei discuții am arătat că în cazul diabetului de tip 2, organismul devine intoxicat cu glucoză și desigur că organismul încearcă să scape de ea.
Introducerea consumului de alimente procesate este una din principalele surse ale bolilor civilizației moderne. Cele mai multe din aceste boli moderne sunt în fapt efecte secundare ale perturbării metabolismului glucidelor și/sau lipidelor urmate de insulinorezistență.
Studii recente admit că o dietă nesănătoasă și lipsa activității fizice sunt principalele cauze ale morții premature în Statele Unite;
Unhealthy eating and physical inactivity are leading causes of death in the U.S
https://www.cspinet.org/eating-healthy/why-good-nutrition-important
Este evident pentru oricine că majoritatea produselor alimentare procesate și frumos etichetate nu mai sunt de mult timp alimente. Ele au un preț modic și de aceea sunt vândute în cantități industriale, au savoarea și aparența alimentelor adevărate dar acestea sunt doar aparențe. În spatele fiecărui asemenea aliment procesat se ascunde o întreagă industrie chimică care le face să apară drept ,,perfecte”.
Anterior am introdus conceptul de ,,teroarea glucidelor” în organism și acum am căutat și referințe pentru asemenea efect. Există un studiu relevant în această direcție și am să citez rezumatul acestui articol în original și apoi o traducere și scurtă prezentare în română.
https://pubmed.ncbi.nlm.nih.gov/23803881/
Effects of dietary glycemic index on brain regions related to reward and craving in men
Belinda S Lennerz 1, David C Alsop, Laura M Holsen, Emily Stern, Rafael Rojas, Cara B Ebbeling, Jill M Goldstein, David S Ludwig
PMID: 23803881 PMCID: PMC3743729 DOI: 10.3945/ajcn.113.064113
Abstract
Background: Qualitative aspects of diet influence eating behavior, but the physiologic mechanisms for these calorie-independent effects remain speculative.
Objective: We examined effects of the glycemic index (GI) on brain activity in the late postprandial period after a typical intermeal interval.
Design: With the use of a randomized, blinded, crossover design, 12 overweight or obese men aged 18-35 y consumed high- and low-GI meals controlled for calories, macronutrients, and palatability on 2 occasions. The primary outcome was cerebral blood flow as a measure of resting brain activity, which was assessed by using arterial spin-labeling functional magnetic resonance imaging 4 h after test meals. We hypothesized that brain activity would be greater after the high-GI meal in prespecified regions involved in eating behavior, reward, and craving.
Results: Incremental venous plasma glucose (2-h area under the curve) was 2.4-fold greater after the high- than the low-GI meal (P = 0.0001). Plasma glucose was lower (mean ± SE: 4.7 ± 0.14 compared with 5.3 ± 0.16 mmol/L; P = 0.005) and reported hunger was greater (P = 0.04) 4 h after the high- than the low-GI meal. At this time, the high-GI meal elicited greater brain activity centered in the right nucleus accumbens (a prespecified area; P = 0.0006 with adjustment for multiple comparisons) that spread to other areas of the right striatum and to the olfactory area.
Conclusions: Compared with an isocaloric low-GI meal, a high-GI meal decreased plasma glucose, increased hunger, and selectively stimulated brain regions associated with reward and craving in the late postprandial period, which is a time with special significance to eating behavior at the next meal. This trial was registered at clinicaltrials.gov as NCT01064778.
Deci, studiul se intitulează: Efectele indicelui glicemic dietetic asupra regiunilor creierului legate de recompensă și pofta la bărbați și are ca obiectiv examinarea efectele indicelui glicemic asupra activității creierului în perioada postprandială târzie, după un anumit număr de ore.
Un număr de 12 bărbați supraponderali sau obezi au consumat alimente cu indice glicemic mare sau mic după un anumit protocol experimental iar rezultatele observate sunt mai mult decât surprinzătoare.
Saltul de glicemie a fost de 2,4 ori mai mare după masa cu indice glicemic mare decât după masa cu indice glicemic scăzut. Senzația de foame, după 4 ore a fost mai mare in cazul consumului alimentelor cu indice glicemic mare decât în celălalt caz, și foarte important, glucoza în sânge scade la un minim istoric -fig.1.
Masa cu alimente având indice glicemic mare a provocat o activitate cerebrală mai intensă într-o zonă a creierului asociată cu recompensa și pofta.
Desigur că studiul este interesant să fie citit în original de către cei de specialitate, însa eu am să mă rezum la interpretarea datelor prezentate in fig. 1, care e copiată din respectivul studiu.
În cazul unui consum de alimente cu indice glicemic mare se observă că, într-o primă fază glicemia crește rapid în sânge, apoi după ce intervine insulina, are loc o scădere drastică a glicemiei, chiar sub valori mai mici decât valoarea inițială de plecare.
Practic consumarea unor alimente cu un indice glicemic mare face ca organsimul să basculeze tot timpul între valor extreme ale glicemiei, în funcție și de cât de repede insulina reușește să intervină. Dacă acestă basculare între minim și maxim e tolerabilă ocazional, cu siguranță nu e ceva de dorit pentru o funcționare optimă și pe termen lung a organismului, chiar și în cazul unui organism perfect sănătos.
În cazul consumării unor alimente cu indice glicemic mic, nu există un salt de glicemie așa brusc, iar după masă, variația de glicemie e aproape neglijabilă.
Pentru aceeași cantitate de calorii, după cum se observă în al doilea grafic din fig.1, consumul de insulină este mult mai mare în cazul alimentelor cu indice glicemic mare decât pentru cele cu indice glicemic mic. Este normal ca un asemenea ,,exces” de insulină să aibă apoi alte efecte metabolice în organism..
Ca idee generală, chiar și pentru un organism sănătos, este de preferat ca meniul să fie adaptat în așa manieră încât producția (sau necesarul) de insulină să fie cât mai mică.
Cel mai important fapt care trebuie subliniat e că senzația de foame este tot timpul mai intensă după consumarea alimentelor cu indice glicemic mare în comparație cu cele cu indice glicemic mic – ultimul grafic din fig 1. Consecința e usor de imaginat: trebuie să iei mai multe mese pe zi (uneori chiar 6-7) pentru a astâmpăra foamea. Desigur că pentru o zi sau o lună, nu realizezi consecințele faptului că ai consumat câteva sute de calorii în plus pe zi. Însă, pe termen lung, masa corporală crește....
Aici e un extras de pe o pagină web care prezintă modificările obiceiurilor culinare ale cetățenilor americani în ultima jumătate de secol:
https://www.vox.com/2016/5/18/11704458/american-diet-changes
More of everything: Aside from sprinkling cheese on everything, these charts might seem like good news. Swapping in dark greens for iceberg lettuce and chicken for beef are healthy substitutions. But Americans are also just eating more: 500 more calories per day than in the 1970s, and 800 calories per day more than in the late 1950s. Most of those calories come from fats, oils, and refined grains, according to the USDA.
Metabolismul corpului uman nu s-a modifcat în decurs de jumatate de secol, iar activitatea fizică s-a diminuat din diverse motive, obiective sau subiective.
Nu e necesar să ai multă știință ca să deduci care e rezultatul pe termen lung al unui adaos suplimentar de circa 800 de calorii la dieta zilnică a unei persoane, combinat cu reducerea activității fizice.....
La această situație adaugă și reclama insidioasă a firmelor alimentare care te tentează cu tot felul de produse industrializate fără relevanță nutritivă reală, dar care sunt pline de substante adictive și au un preț convenabil.
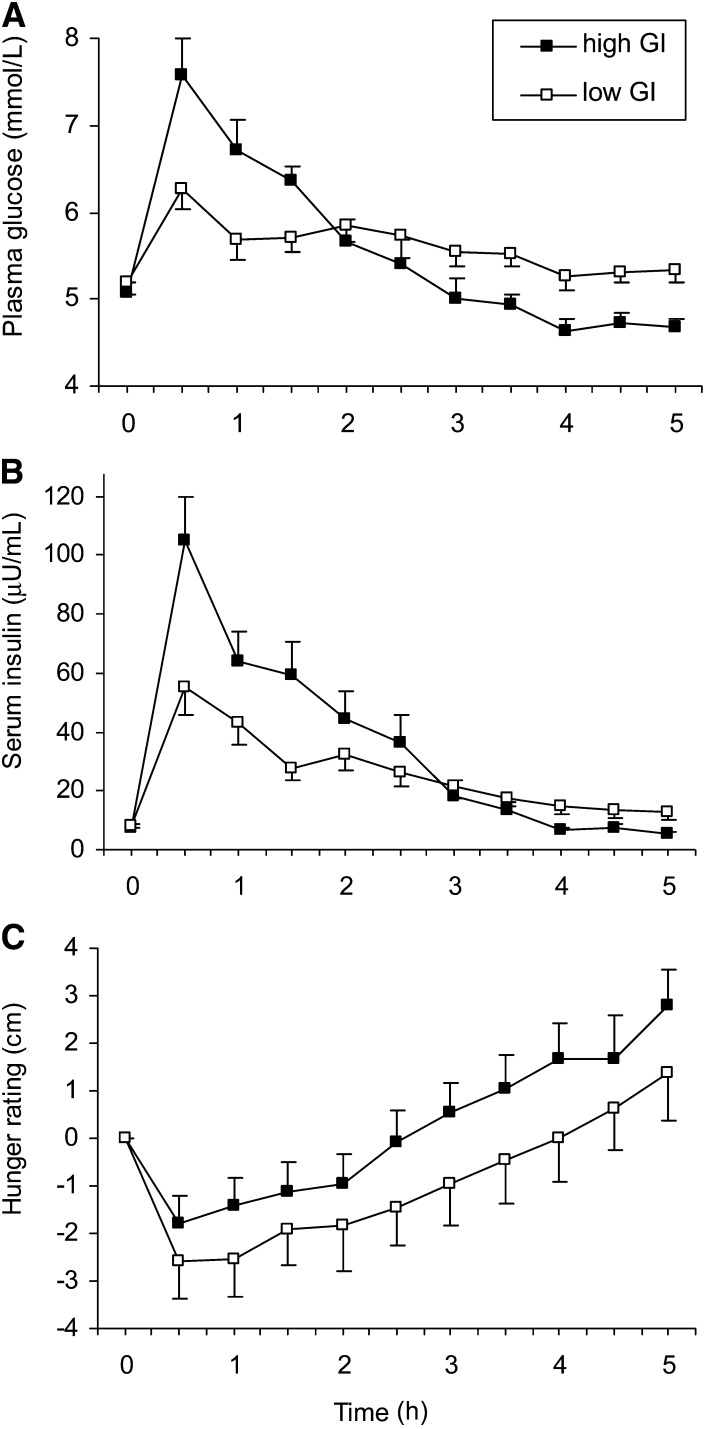
Figura 1. Valori medii ale glucozei in sânge (A), insulinei (B), și foamei (C) după administrarea meselor. (picture from the study, under copyright)
Altă idee foarte importantă, care este omisă să fie prezentată publicului larg, e că insulina e un hormon anabolic și lucrează în opoziție cu alt hormon produs de ficat glucagonul (a nu se confunda cu glicogenul care e un polizaharid), care e un hormon catabolic.
Insulina, ca hormon anabolic, promovează absorbția glucozei, glicogeneza, lipogeneza și sinteza proteinelor a mușchilor scheletici și a țesutului adipos prin calea receptorului tirozin kinazei.
Glucagonul este un hormon catabolic, facilitand “înfometarea” celulelor și arderile. În cazul țesutului adipos, glucagonul conduce la lipoliza și implicit dispariția acestuia.
ATÂT TIMP CÂT NIVELUL INSULINEI E RIDICAT, NU AI CUM SĂ SLĂBEȘTI PENTRU CA GLUCAGONUL NU POATE LUCRA EFICIENT!!!!
În alți termeni mai simpli, e inutil să își chinui organismul să slăbească atât timp cât nu găsești o modalitate de a diminua nivelul insulinei în organism.
Există multe persoane care vor într-adevăr să slăbească (pentru diabet sau chiar si pentru alte motive) și nimeni nu le explică anumite aspecte esențiale ale acestui proces. Unii se chinuie câteva luni și trec prin momente dramatice, fără să ajungă la un rezultat semnificativ. Dacă după asemenea chin reușesc să scadă câteva kg e deja o performanță, însă după puțin timp revin la greutatea inițială. Toate acestea se întâmplă pentru că nivelul insulinei e ridicat în organism.
Sunt unii care nu numai că nu slăbesc când insulina e ridicată, dar cu un program fizic susținut și intens ajung să adauge alte kg la masa inițială.
Cineva ar crede că așa ceva e imposibil, însă din păcate e posibil și totul e doar un efect secundar la ,,terorii glucidelor” în organism.
Explicația e destul de simplă, chiar dacă nu o știu mulți.
În mod normal organismul e poate să funcționeze pe baza a doi cumbustibili: glucide și lipide, dar are preferința să consume mai întâi glucidele.
În timp ce exersezi corpul fizic, organismul consumă glucidele care le are la dispoziție și apoi ar trebui să schimbe combustibilul și să înceapă să ardă grăsimile.
Ficatul depozitează undeva la 140 g de glicogen (un polimer al glucozei) și desigur că mușchii au și ei o rezervă de glicogen. Toată această rezervă de glucide ar trebui să fie consumată după circa 15 ore de post negru sau după un exercițiu intens cu o durată mai mare de câteva ore.
Dacă nivelul insulinei rămâne ridicat în organism, și rezerva de glucide s-a terminat, organismul nu are capacitatea de a trece la al doilea combustibil, adică lipide și ..cere de mâncare”.
E necesar un mare efort de voință pentru ca cineva în această situație să își impună să nu mănânce pentru a ,,forța” organismul să treacă la consumarea lipidelor.
Dacă nu ești atent la acest simplu fapt, cu tot exercițiul fizic susținut, ingerarea de mâncare când ești tot în faza de ardere a glucidelor face ca insulina crescută din organism să ducă la creșterea atât a masei musculare cât și a țesutului adipos.
Insulina depozitează orice poate, unde poate și rezultatele cele mai bune le obții atunci când cunoști cum funcționează și reușești să îi controlezi nivelul în organism.
Chiar și după ce ești sigur că nivelul de insulină e scăzut în organism, consumarea unei mese care conține simultan glucide și lipide în procente mari, va avea un efect care e previzibil pentru oricine a înțeles cum funcționează acest hormon. În acest ultim caz, insulina va fi secretată să controleze glucidele, și în același timp va transporta și lipidele în țesutul adipos. Cu siguranță nu vei slăbi în aceste condiții...!!!!
Aceste lucruri gnerale sunt cunoscute de mult timp, dar sunt cunoscute la nivel ezoteric, fără a fi aplicate în practică.
Toți dieteticienii sau medicii îți recomandă să mănânci mai puțin și să exersezi mai mult, dar chiar dacă ai făcut asta fie nu funcționa deloc, fie puneai înapoi cele câteva kg în termen mai scrut decât cel în care te-ai chinuit să le dai jos. Acum înțelegi de ce și e simplu să urmezi o abordare mai pragmatică a problemei.
Informația despre efectele insulinei este cunoscută mai ales din studiile efectuate pe diabeticii de tip 1. În acest caz, pancreasul nu produce destulă insulină și înainte de a avea insulină injectabilă, aceștia erau tot timpul în pericol de a face comă hiperglicemică.
Dacă cineva are curiozitatea să caute foto cu asemenea bolnavi în stare de hipoinsulinemie prin atlase sau manuale de medicină mai vechi va vedea că corpul lor fizic era ca un schelet plimbător, fără masă musculară și fără un minim țesut adipos necesar organismului.
După ce s-a găsit modalitatea de a avea insulină, mai întâi extrasă de la porc sau vită apoi produsă pe cale sintetică, și dacă acești bolnavi urmau o dietă normală, insulina asigura formarea țesutului muscular și adipos.
Dacă însă acești diabetici de tip 1 urmau o dietă dezechilibrată cu multe glucide și lipide, atunci prindeau proporții și deveneau supraponderali sau obezi pe baza excesului de insulină administrat.
Diabetul de tip 2 și metabolismul lipidelor
Există anumiți medici care presupun că insulinorezistența este cauzată de o perturbare a metabolismului lipidelor și există mult adevăr în această afirmație. Nu am să intru în polemică pe această temă pentru că pentru mine mai important să caut o soluție.....
Este cunoscut de mult timp că grosimea stratului de lipide depus în jurul abdominale e direct corelat cu insulinorezistența.
Istoric vorbind acest strat de lipde abdominale e în principal o consecință a unui exces alimentar, dar după ce acest strat prinde proporții, evoluția lui e diferită și există două căi principale: hipertrofia și hiperplazia.
În cazul hipertrofiei – fig. 2, celulele țesutului adipos cresc în dimensiuni, și pe măsură ce se continuă cu abuzul de alimente, apare inflamarea, lipotoxicitatea etc.
În cazul hiperplaziei, situația e mai favorabilă – fig. 2, pentru că noi celule adipoase sunt secretate și pe măsură ce excesul alimentar continuă, surplusul care vine se depozitează în noile celule.
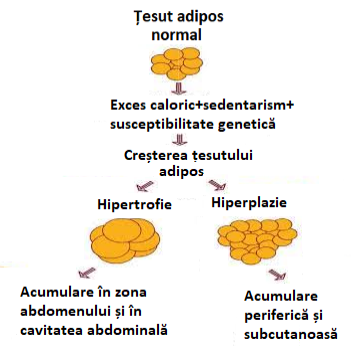
Figura 2 Hipertrofia și hiperplazia țesutului adipos
Regula generală e că în cazul hipertrofiei insulinorezistența și apoi diabetul tip 2 evoluează simultan cu creșterea țesutului adipos.
În cazul hiperplaziei, această regulă nu e respectată tot timpul și există obezi care ajung să aibă câteva sute de Kg, fără insulinorezistență și fără diabet de tip 2.
În fig. 2 se prezintă și principalii factori care conduc la creșterea țesutului adipos și anume: excedentul alimentar, sedentarismul și predispoziția genetică. Cei care vor să găsească o scuză pentru excesul de lipide dând vina pe susceptibilitatea genetică se amăgesc singuri; dacă ai ochii migdalați atunci poți da vina pe gene!
În mod normal, la un organism sănătos, lipidele sunt depozitate subcutanos, cel puțin în faza inițială a excedentului alimentar.
Când acest țesut subcutanos atinge o anumită limită, afluxul de noi lipide începe să fie depozitat în mușchi și organe interne (ficat, pancreas).
Este mai mult decât normal răspunsul întregului organism care, îmbâcsit fiind cu lipide și zaharuri, refuză să mai accepte o nouă cantitate de glucoză în celule și dezvoltă insulinorezistența.
De fapt cum transferul glucidelor și a lipidelor e mediat de insulină, celulele organismului refuză nu numai glucoza, dar și lipidele în egală măsură. Problema e că în cazul lipidelor acestea nu sunt controlate așa strict ca glucoza și atunci nu apar ca un semnal critic pentru organism.
Un diabetic de tip 2 ar trebui să conștientizeze că de fiecare dată când ia o masă abundentă, celulele organismului țipă că nu mai au ce face cu atâtea glucide și lipide.
În principiu este posibil ca cineva să ajungă la insulinorezistență și apoi diabet de tip 2 datorită consumului exagerat de glucide, consumului exagerat de lipide sau și mai repede din combinarea lor. Trebuie subliniat că o combinație între glucide și lipide în proporție mare în alimente e lozul câștigător ca să devii obez și apoi diabetic. Metabolizarea glucidelor va împiedica arderea lipidelor și astfel din ce ingeri o parte se consumă și o parte se depune.
Toate alimentele procesate care stau veșnic pe rafturile magazinelor au un procent însumat de glucide plus lipide de aproximatv 90%, iar unii se întreabă de unde vine epidemia de diabet ....
În articole ulterioare voi încerca să prezint mai pe larg aspecte legate de metabolizarea glucidelor, lipidelor pentru ca o persoană obișnuită să aibă idee de consecințele pe termen lung ale unei diete aiurea.
Cât privește epidemia actuală de obezitate și diabet tip 2, aceasta e mai mult ca sigur provocată de un exces de glucide, și în special cele rafinate și procesate iar întregul proces e amplificat de lipide.
Metabolismul glucidelor e puternic corelat cu metabolismul lipidelor pentru că excesul de glucide e tot timpul transformat și depozitat sub formă de lipide în organism.
E usor de înșeles cum de glucidele ajung să fie toxice pentru organism atunci când sunt consumate ăn exces.
Am văzut că metabolizarea glucidelor are loc simultan cu o depunere a lipidelor în organsims sub efectul insulinei.
Dacă însă ingerezi o doză mai mare de glucide decât necesarul organismului, excedentul de glucide e transformat în lipide și atunci organismul trebuie să facă față nu doar lipidelor ingerate ci și unei cantități de lipide provenite din transformarea zaharurilor.
E important de subliniat un aspect cheie: pentru organism nu e așa important care e sursa lipidelor, mai important e consecința acumulării lor și în special când lipidele ajung să fie depozitate în țesutul muscular și organele interne.
Chiar și în cazul în care diabetul de tip 2 ar fi provocat direct de anumite perturbații inițiale în metabolismul lipidelor, tot trebuie schimbată definiția diabetului de tip 2 ca o stare a organismului in care glucoza devine o toxină.
Pentru a vedea cum este perturbat mecanismul lipidelor în cazul diabetului de tip 2, e necesar să revenim la discuția din prima parte a articolului.
În faza de insulinorezistență, când deja glucidele din alimentație sunt mai mult decât necesarul organismului, ficatul deja e obosit și lucrează la limite extreme.
Organismul nu are capacități ,,extreme” de a depozita glucidele pe termen lung și atunci ficatul le convertește în lipide. Ca idee generală, ficatul depozitează maxim 140 g ca glicogen și o altă cantitate de glicogen în țesutul muscular. Cantitatea de glicogen depozitată în țesutul muscular depinde de o întreagă serie de factori și nu e posibil să ai o estimare precisă.
O dată ce glucidele sunt convertite în lipide (în termen chimic sau medical sunt cunoscute ca trigliceride), acestea sunt apoi transportate în celule. Cam peste tot în organism există țesuturi adipoase care depozitează aceste lipide ca rezerve energetice pentru zile negre, dar implicit organsimul e adătat să depoziteze majoriattea lipidelor subcutanat.
Este important de subliniat, și puțini din afara sferei medicale știu că insulina este importantă pentru transportul lipidelor în celule. Fără insulină, celulele corpului nu permit acizilor grași din lipide să traverseze membrana celulară la fel cum nu permit zaharurilor.
Și mai important de subliniat e faptul că organismul nu are implementate niște nivele de control așa stricte pentru lipide ca pentru glucide. Teoretic vorbind, un organism poate în principiu să producă și să stocheze orice cantitate de lipide. Asta nu înseamnă că funcționarea altor organe sau a întregului organism nu e afectată de un excess de lipide, dar în anumite situații consecințele nu sunt așa grave.
Am citit cazul unui scoțian care a postit pentru 382 zile și a pierdut 125 kg de grăsime (wikipedia Angus Barbieri case). Desigur că era un caz fericit pentru că avea hiperplazie și nu hipertrofie.
Este evident că nu e sănătos să ai asemenea depozit de grăsime și majoritatea organismelor nu tolerează așa ceva, iar în marea majoritate a cazurilor apar complicații majore ca diabetul, probleme cardiace, etc., înainte ca țesuturile adipoase să cântărească 100 kg.
Politica actuală alimentară și consecințele ei dezastruoase, e bazată pe o alimentație bogată în glucide rafinate, dar același rezultat s-ar obține și cu o politică bazată pe lipide în concentrație mare.
Glucidele au nevoie de ficat pentru ca excesul lor să fie transformat în lipide care apoi sunt transportate în celule.
Fructoza, un alt reprezentant al familiei glucidelor, e prezentă în aproape orice aliment procesat industrial și e una din cauzele principale ale epidemiei de boli moderne.
Acest monozaharid, scapă de obicei investigațiilor aprofundate și există chiar recomandări că diabeticii pot consuma fructoză întrucât nu crește nivelul glicemiei!!!! Ce eroare grosolană!
Organismul nu poate folosi fructoza ca sursa directă de energie și atunci o mică parte reușește să o convertească în glucoza iar restul în lipide; desigur că tot ficatul face aceaste transformări și aceste procese obosesc ficatul.
Fructoza e și mai problematica pentru diabetici și ei trebuie să cunoască metabolismul aparte al acestui compus.
În natură fructoza e prezentă în fructe în anumite doze variabile și o anumită doză de fructoză e ceva firesc și tolerabil pentru organism.
Dacă cantitatea de fructoză care ajunge să fie ingerată de o persoană normală sau diabetică depășește limita de toleranță a organismului, atunci încep complicațiile.
În mod normal ca să depășești toleranța organismului ar trebui să consumi anual fie câteva tone de fructe conținând fructoza sau câteva sute de litri de băuturi răcoritoare sau sucuri de fructe îndulcite cu fructoză, presupunnd că nu consumi nici un alt aliment care conține fructoză natural sau adăugată. Acum fructoza este prezentă nu doar în băuturi răcoritoare, ci și în alimente dietetice, ketchups, iaurturi, maioneză, pâine, biscuiți, prăjituri, etc.
Care dintre aceste două posibilități ți se pare mai probabilă?
Transformarea fructozei in glucoză în ficat nu e ceva standard și fiecare organism convertește un procent mai mare sau mai mic în funcție de o întreagă serie de factori metabolici. Ca urmare pentru un diabetic, după câteva ore de la ingerarea unei cantități de fructoză e posibil să apară o glicemie mărită fără o cauză aparentă. Restul de fructoză este transformat în lipide și asta conduce la ficat gras urmat de trigliceride crescute în sânge – fig. 3.
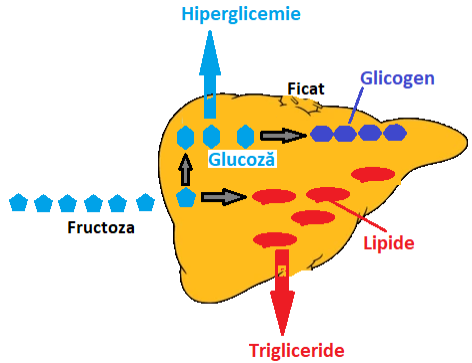
Figura 3 Principalele transformări ale fructozei în ficat
Pentru cei interesați există o întreagă serie de materiale pe youtube despre fructoză și epidemia de obezitate, iar dr. Robert Lustig e unul din pionerii în domeniu care lămurește multe aspecte ale metabolismului și efectelor pe termen lung a fructozei pentru organism.
https://www.youtube.com/watch?v=ceFyF9px20Y
Fat Chance: Fructose 2.0
https://www.youtube.com/watch?v=cgTlFFWMNy0
Fructose is a poison
Ca să revenim la discuția noastră principală, insulina transportă lipide nu doar în țesutul adipos ci și în țesutul muscular, dar desigur că celula musculară are altă funcție și are o limită de stocaj a lipidelor mult mai mică decât celula adipoasă. Apoi doza stocată în mușchi depinde de masa musculară și această masă musculară e variabilă de la individ la individ, variabilă cu sexul individului și variabilă cu vărsta, etc.
Ideea de bază e că la un moment dat și celulele țesutul muscular ajung să aibă destule rezerve de lipide, și consideră că nu mai au unde depozita alte rezerve suplimentare.
Acesta e un moment cheie pentru organism și în acest moment se declanșează diabetul de tip 2 când deja există o saturare a organismului cu lipide la care se adaugă ingerarea tot mai crescută de glucide. Desigur că este posibil ca pe acest fundal să existe alți factori secundari ce pot declanșa acest proces cum ar fi un stress prelungit, șoc emoțional, etc.
Un mic procentaj din persoane care ajung la acest punct cheie, și au o rezistență crescută a organismului sau genele potrivite, continuă să transforme tot ce ingeră în grăsime și ajung la proporții considerabile iar în cazul lor insulinorezistența nu conduce la diabet de tip 2 sau alte complicații metabolice majore.
Pentru discuția de față e interesant ce se întâmplă cu majoritatea organismelor, când pănă și organele interne cum ar fi ficatul și pancreasul ajung să fie îmbâcsite cu lipide, iar glucoza începe să devină o toxină.
Este adevărat că la aceeași situație se poate ajunge și în cazul în care se consumă o alimentație bogată în lipide pentru timp îndelungat pentru că este demonstrat clinic că animalele de laborator ajung la insulinorezistența și prin administrarea unei cantități mari de lipide.
Pentru o firmă farmaceutică interesată să promoveze un medicament care să țină diabetul sub control, e de importanță capitală să cerceteze fiecare pas sau fiecare detaliu al mecanismului lipidelor sau glucidelor, eventual interdependența între ele, pentru a vedea în ce punct din această succesiune de etape un medicament e eficient și care sunt consecințele administrării lui.
Pentru un bolnav care își dorește să scape de diabetul de tip 2, și aceasta e sigur posibil în fazele de început deși eu cred că e posibil și în faze mai avansate, e mai important să aibă o viziune de ansamblu și eventual să aibă o idee clară despre anumite variabile care daca sunt controlate sau modifcate pot influența dramatic evoluția bolii într-o direcție sau alta.
Poate că pentru unii indivizi e relevant să se analizeze retrospectiv dacă dezvoltarea diabetului a avut loc pe un fond glucidic sau lipidic, însă acestea sunt date statistice și nu cred că ajută la rezolvarea problemei.
Însă, din punctul meu de vedere, este complet eronat să presupui că există o epidemie de diabet tip 2 datorată lipidelor când ideologia actuală presupune că alimentația populației se face cu un procent de cel puțin 60% glucide din care mai mult de jumătate sunt rafinate.
Dacă în viitor se va trece la o politică alimentară bazată pe multe lipide, desigur că se va ajunge la o insulinorezistență datorată lipidelor, cu efecte similare sau poate și mai grave.
Există un studiu remarcabil efectuat la universitatea Yale care, aparent ar susține idea că diabetul de tip 2 e cauzat de cantitatea crescută de lipide în țesutul muscular.
https://www.jci.org/articles/view/10583
THE JOURNAL OF CLINICAL INVESTIGATION
Cellular mechanisms of insulin resistance, Gerald I. Shulman
Primul lucru important pe care acest studiu îl face e că analizează în ce măsură țesutul muscular al unui diabetic de tip 2 produce glicogen în comparație cu o persoană sănătoasă.
Ideea e că glucoza e transportată de sânge ca monomer, iar după ce intră în celulă se polimerizează sub formă de glicogen.
Rezultatele acestei comparații arată că la pacienții cu diabet de tip 2, rata de sinteză a glicogenului muscular a fost cu aproximativ 50% mai mică decât la voluntarii normali.
Cum articolul meu e dedicat celor care au diabet dar nu au studii de medicină, am să dau altă interpretare ideii de mai sus, presupunând că ficatul e deja plin cu glicogen și nu mai depozitează nimic. Daca un pacient cu diabet de tip 2 și o persoană sănătoasă consumă 100 g de glucoză, la pacientul cu diabet doar 50 g ajunge în țesutul muscular și e transformat în glicogen în vreme ce la pacientul sănătos 100 g de glucoză ajung în țesutul muscular și e transformat în glicogen. Asta înseamnă că diabeticul rămăne cu 50 g de glucoză în sânge, cu consecințe pe care oricine le poate imagina....
Poate o medicină modernă să chinuie pancreasul să secrete și mai multă insulină, când acest studiu demonstrează că ,,problema” e la nivel muscular?
Studiul merge mai departe și cum ei sunt interesați de găsirea unui medicament pentru diabet, se analizează fiecare etapă în transformarea glucozei în glicogen – fig. 4.
Glucoza ajunge la peretele celular unde insulina trebuie să deschidă ,,canalul” Glut4 (nu e important pentru omul de rând ce reprezintă glut4). După ce acest canal e deschis, glucoza trece trece de peretele celular și anumite enzime specifice acționează asupra ei și în final o transformă în glicogen.
Autorii analizează fiecare etapă din transformarea glucozei cu au o abordare destul de practică și rezonabilă. Spre exemplu, ei argumentează că dacă în celula diabeticului ar observa o cantitate mai mare de UDP-glucoză decât în celula unei persoane normale, ar însemna că ultima enzimă glicogensintaza nu lucrează și anumite medicamente pot fi testate pentru a îmbunătăți acest pas. Raționamente asemănătoare se fac pentru orice alt pas intermediar al glucozei.
Din punctul de vedere al unei companii farmaceutice această abordare e logică și consistentă. Din punct de vedere al organismului e dăunătoare și absurdă.
Practic un medicament pentru diabet ar ,,corecta” un pas intermediar al glucozei, și ar transforma celula într-un mutant care e capabil să accepte o cantitate mai mare de glucoză decât ea poate duce cu consecințe dezastruoase pe termen lung.
Medicina modernă încearcă să introducă un fel de gavaj celular, adică o hrănire forțată a celulelor mult peste necesarul lor energetic.
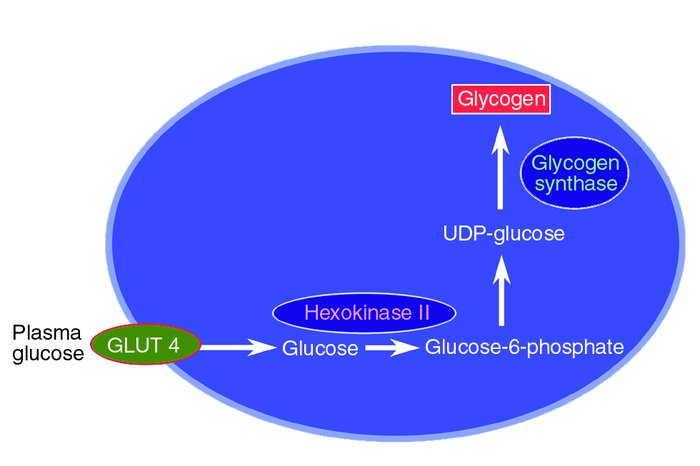
Figura 4 Transportul și transformarea glucozei în celulă
Nu e mare deosebire între ce vezi in fig. 5 unde o gâscă e chinuită și i se face gavaj forțat cu grăunțe ca să se obțină specialitatea numită ,,fois gras” și ce vrea medicina să facă pentru celulele tale.
Ca idee generală, studiul conclude că în celula diabeticului, factorul determinat care limitează sinteza glicogenului este restricția impusă de Glut4; adică celula în sine refuză să permită intrarea glucozei în celulă. Desigur că studiul e doar în faza incipientă și în faze ulterioare se încearcă găsirea unor pilule care să forțeze deschiderea canalului glucozei (Glut4) și trasportul unei cantități suplimentare de glucoză în celulă.
Ideologia generală predicată de medicina oficială e că în vreme ce celula suferă din cauza absenței de glucoză, Glut4 nu permite intrarea glucozei deși sângele are un exces de glucoză.
Cred că ideea de mai sus e doar folclor pentru că nu am găsit până acum un singur studiu care să demonstreze că celulele organismului suferă din lipsă de combustibil la diabeticul de tip 2 și cel puțin pentru rasa caucaziană, care dezvoltă această boală pe un fond de obezitate, așa ceva e imposibil.
Până și pentru nivelul de înțelegere al unei persoane obisnuite e destul de clar că un supraponderal sau obez nu poate avea deficiențe energetice la nivel de țesuturi. Care e rolul lipidelor în organism, dacă nu să asigure un necesar energetic atunci când e penurie de alimente?!
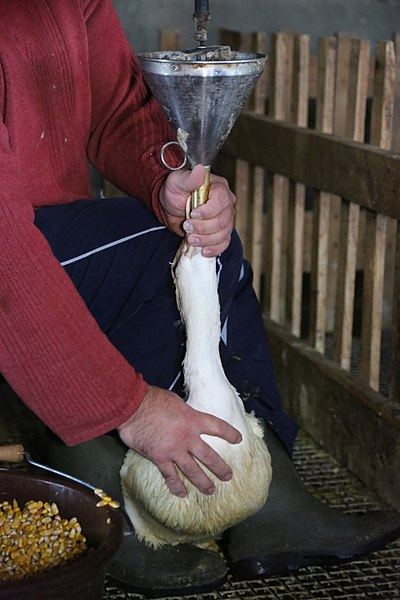
Figura 5 Gavaj forțat al găștelor pentru a obține fois gras
Însă, un studiu care să arate că de fapt întreg organismul unui diabetic de tip 2 pentru rasa caucaziană, dezvoltat pe un fond supraponderal, are un excedent de rezerve energetice, nu e pe placul firmelor farmaceutice. Un asemenea studiu ar conclude că organismul e suprasaturat cu glucide și lipide, iar măsura cea mai rațională care trebuie luată e să treci la un regim cu restricție de calorii și activitate fizică. Dacă nu e medicament, nu e profit pentru firmă!
Studiul merge mai departe și analizează influența lipidelor în țesutul muscular asupra rezistenței la insulină. Concluzia la care se ajunge e mai mult decât firească: țesutul muscular caruia i se induce o concentrație mai mare de lipide e de asemenea mult mai rezistent la acțiunea insulinei.
Ca și chimist nu înțeleg ce vrea să facă medicina modernă cu acest țesut muscular!!!
Care e rolul lui principal în organism?
Dacă rolul țesutului muscular e de efectua o funcție motorie, e clar până și pentru mintea găinei că această funcție nu poate fi îndeplinită dacă acest țesut muscular e transformat în țesut adipos sau dacă e suprasaturat cu lipide și glucide!
La o persoană sănătoasă, țesutul muscular e sigur cel mai mare depozit temporar de glucide; apoi aproape orice celulă a organismului are și ceva lipide în compoziția ei și implicit celula usculară.
O știință medicală rațională ar trebui să considere că e primordial să constate dacă țesutul muscular nu e deja saturat în lipide și glucide înainte de a căuta tot felul de metode de a împinge alte glucide sau lipide în aceste țesuturi.
Care ar fi apoi metoda cea mai simplă să eliberezi țesuturile musculare de rezervele de lipide și glucide în așa fel ca ceea ce ingerezi să găsească și spațiu liber și să fie o necesitate pentru organism?
Crezi că o pilulă de la farmacie ar putea face așa ceva?
Există mai multe ipoteze cum țesuturile organismului devin treptat insulinorezistente și această discuție e pentru un nivel avansat și probabil va fi prezentată într-un alt articol; ideea e că inițial țesutul adipos devine insulinorezistent, și apoi semnalează și altor țesuturi acest fapt.
Există altă informație importantă care merită prezentată și cunoscută de bolnavii de diabet pentru că e folistoare în vederea adoptării unei tactici de remisie/eliminare a bolii.
Funcționarea defectuasă a pancreasului are la bază trei cauze principale care sunt deja acceptate de medicina modernă: glocotoxicitatea, lipotoxicitatea și inflamația.
Glucotoxicitatea înseamnă toxicitatea indusă de glucoză, deși până acum medicii sunt reticenți la a accepta această idee.
Există un studiu magistral care demonstrează glucotoxicitatea la nivelul pancreasului și pentru specialiști referința e: D. Ross Laybut et all, J. Biol. Chem. 2003, 278, 2994-3005.
Ideea de bază a acestui studiu a fost să demonstreze ce se întîmplă în pancreas atunci când nivelul de glicemie crește. După cum se știa chiar înainte de acest studiu, în pancreas diferențierea celulelor stem în celule de tip beta (care secretă insulina) e influențată de nivelul de glucide în sânge. Pentru un diabetic de tip 2, dacă organismul stă tot timpul la un nivel ridicat de glicemie, atunci tot mai puține celule stem sunt convertite în celule de tip beta și asta face ca în timp cantitatea de insulină secretată de pancreas să scadă.
Studiul merge însă mult mai departe și e interesant de cunoscut atât partea experimentală cât și concluziile.
Un lot de N cobai cu caracteristici similare a fost selectat pentru studiu. N/3 din aceștia au fost selecționați ca lot martor, iar la restul de 2N/3 cobai s-a efectuat o operație de extirpare a unei porțiuni a pancreasului.
La cei 2N/3 s-a indus o stare hiperglicemică, dar din acest lot N/3 au fost din nou selecționați și li s-a administrat florizin, un medicament care facea sa elimine glucidele în urina.
Practic cu aceste manipulări s-a ajuns la următoarea configurație:
- Lotul A - N/3 cobai cu glicemia normală – lot martor;
- Lotul B - N/3 cobai cu pancreas partial extirpat dar cu glicemie crescută;
- Lotul C - N/3 cobai cu pancreas parțial extirpat, dar cu glicemie normală după administrarea de florizin.
Experimentul a continuat cu hrănirea cobailor și menținerea acestor caracteristici specifice pentru fiecare lot pentru căteva luni, după care au fost sacrificați și s-a analizat pancreasul și funcționarea celulelor beta.
E important de subliniat că doar la lotul B, cobai care au avut tot timpul glicemia ridicată, celulele beta erau nefuncționale și procesul de diferențiere a celulelor stem în celule beta era complet blocat.
În cazul lotului C, chiar dacă avea pancreasul parțial extirpat și le-au fost administrate glucide, faptul că glicemia a fost menținuă normal a făcut că celulele beta să funcționeze normal și diferențierea de celule stem în celule beta să nu fie blocată.
Ce altă demonstrație ar avea nevoie medicina modernă ca să concludă că excesul de glucide acționează ca o toxină pentru cazul diabeticului de tip 2?!
Referitor la influența lipidelor asupra funcționării celulelor beta ale pancreasului există un alt sudiu remarcabil publicat de Lao Y et al, International journal of obesity, 34, 396-400.
Acest studiu arată că celulele beta funcționează bine în prezența unui procent mic de lipide, dar pe măsură ce procentul de lipide crește, funcționarea celulelor beta e îngreunată. La doze mari, nu numai că funcționarea celulelor beta aproape încetează, dar diferențierea celulelor stem în celule beta este blocată. Excesul de lipide în pancreas schimbă morfologia celulelor beta și astfel pacientul devine diabetic.
Nu are importanță ,,originea” acestor lipide și e absurd ca cineva să creadă că doar un exces de lipide care au o anumită sursă bine definită provoacă diabetul. Imediat ce ficatul și pancreasul sunt inundate cu lipide, fie că aceste lipide provin din excesul de glucide sau direct din absorbția intestinală a lipidelor alimentare, consecința e acceași pentru organism.
Dacă efectul final e același, există și anumite nuanțe și diferențe.
Cineva trebuie să ia totuși în considerație că metabolismul lipidelor e complet diferit de cel al zaharurilor și pragul de toleranță al organismului e ceva mai mare pentru lipide în comparație cu glucidele în ceea ce privește declanșarea diabetului de tip 2.
Lipidele din alimente sunt absorbite majoritar în intestinul subțire și apoi sunt direcționate în principal către anumite locații specifice în organism. Asta face ca un organism să ajungă să aibă depozite mari de grăsime în anumite zone ale corpului, dar acest lucru nu afectează într-o primă fază organele interne.
Apoi o personă care urmează o dietă bogată în lipide și săracă în glucide va avea un fel de protecție împotriva hiperglicemiei și asta face ca un posibil diabet să se instaureze mult mai târziu. Chiar dacă celulele beta funcționează la 30% capacitate, cu o dietă suprasaturată în lipide nu ai nevoie de mai multă insulină pentru a menține glicemia sub control.
Probabil acesta e explicația că unii devin obezi, dar nu dezvoltă diabet pentru că o dietă bogată în lipide previne situațiile de hiperglicemie în organism. Însă imediat ce la o persoană supraponderală sau obeză dieta se schimbă de la multe lipide la multe glucide, insulina îi sare din scala aparatului.
A treia cauză majoră de funcționare defectuoasă a pancreasului o constituie inflamația din organism. De obicei inflamația e corelată cu obezitatea și există multe studii dedicate acestui aspect.
Materialul de față și precedentul nu contestă faptul că ficatul și pancreasul unui diabetic ajung să fie perturbate și funcționarea lor după instaurarea insulinorezistenței e undeva în ,,regim de avarie”.
Ce se contestă în aceste materiale e faptul că medicina modernă încearcă cu orice preț să transforme aceste organe în ,,superorgane” și menține intoxicația în organism. Consecința e că mergând pe această cale, întreg organismul bolnavului ajunge să fie suprasaturat cu glucide și lipide, iar asta are consecințe dezastruoase pe termen lung.
Există un alt studiu care arată un fapt foarte interesant referitor la instalarea diabetului. La persoanele predispuse la diabet, cu ani sau chiar decenii înainte de instaurarea bolii efective, glucoza din sânge este metabolizată mult mai încet față de pacienții normali. Studiul concluzionează că defectul principal sau cauza principală a bolii trebuie căutată în țesuturile periferice, în principal țesutul muscular și nu în pancreas. Dacă se lasă boala să evolueze desigur că și ficatul sau pancreasul ajung să fie afectate.
Aici e referința pentru cei care au curiozitatea să studieze:
Slow glucose removal rate and hyperinsulinemia precede the development of type II diabetes in the offspring of diabetic parents
J H Warram 1, B C Martin, A S Krolewski, J S Soeldner, C R Kahn
Conclusions: One to two decades before type II diabetes is diagnosed, reduced glucose clearance is already present. This reduced clearance is accompanied by compensatory hyperinsulinemia, not hypoinsulinemia, suggesting that the primary defect is in peripheral tissue response to insulin and glucose, not in the pancreatic beta cell.
Alt studiu interesant arată că există și o corelație între trigliceirde și rezistența la insulină, și aici e referința și o concluzie:
Skeletal muscle triglyceride levels are inversely related to insulin action
D A Pan 1, S Lillioja, A D Kriketos, M R Milner, L A Baur, C Bogardus, A B Jenkins, L H Storlien
The results suggest that in this human population, as in animal models, skeletal muscle insulin sensitivity is strongly influenced by local supplies of triglycerides, as well as by remote depots and circulating lipids.
E POSIBIL SĂ AI REMISIA COMPLETĂ A DIABETULUI ZAHARAT DE TIP 2?
Studiile efectuate până acum arată că în primii aproximativ cinci ani de la apariția dianbetului de tip 2 este posibil ca să obții remisia diabetului de tip 2.
Din punctul meu de vedere eu cred că acest lucru e posibil și în faze mai avansate, însă nu pot face un pronostic pentru că momentan am un singur pacient, mama mea care are diabet de mai bine de patru decenii. După trei săptămâni de regim e încă prematur să dau verdicte.
În ipoteza cea mai sumbră că un pacient cu diabet avansat nu reușeste să intre în remisie totală, informația de aici și un regim similar cu cel care îl urmează mama mea îi va fi de mare folos.
Desigur că remisie totală înseamnă pentru mine o funcționare normală a organismului. Dacă ții un diabetic pe conopidă și brocoli toată ziua, aceea nu e remisie totală ci doar un control al glicemiei.
Spre exemplu, acum câteva luni, în cazul mamei mele, ajunsese să nu mai coreleze așa bine insulina cu regimul alimentar și se trezea că măsura glicemia și era peste scala aparatului. Apoi făcea o insulină suplimentară și se trezea noaptea cu frisoane de hipoglicemie, etc. Pe lângă controlul glicemiei, lua un pumn de pastile în fiecare zi pentru alte complicații secundare, și tot era depresivă, letargică, fără energie, etc. Ajunsese să îi fie frică să travesrseze strada pentru că mișcându-se greu, se temea că vine o mașină și o accidentează. Avea senzație de greutate în picioare și o dureau încheieturile, etc.
Pentru 10 zile am spus să nu ia nici insulină nici alte pastile să vedem ce se întâmplă și ce simptome marcante de boli are. În absența altor indicatori, doar insulina era verificată de trei ori pe zi ca să nu se trezească cu surprize. Regimul era strict în aceste zile: legume la cuptor sau fierte cu un pic de qinoa sau orz fiert și câte un fruct.
În această perioadă a fost posibil să ajungă să controleze foarte bine glicemia prandiala (cea generată de ce mânca) dar nu a fost posibil să scadă glicemia bazală (cea măsurată dimineața pe stomacul gol). După 10 zile fără insulină, glicemia de bază a urcat progresiv până la valoarea de 290 și atunci am considerat că e necesar să facă o corecție cu insulină de lungă durată. Acum face doar o singură doză de insulină de 15 unități pe zi (în ultimul an făcea în jur de 30 unități pe zi) iar controlul glicemiei e ca la ceas. Dimineața se trezește cu glicemia 100-120 iar după ce mînâncă glicemia este 190-210. Dacă după o masă glicemia sare peste 250, deja are misiunea să analizeze cauza care a generat această valoare.
Ca și calitatea vieții, nu există comparație între înainte de programul acesta și acum. Mai ia din când în când doar câte o pastilă pentru colesterol și pentru hipertensiune. Ultima valoare pentru colesterolul total a fost 234 iar tensiunea e 18/10. Apoi dacă înainte se temea să traverseze strada, acum trebuie să îi spun să stea acasă că altfel ea are ,,vizite” de făcut.
Ideile de bază pentru cei care vor să urmeze un asemenea program sunt simple: trebuie să elimini sau cel puțin să limitezi intoxicația și să îi creezi organismului condiții pentru a se reface.
E important să vedem ce au făcut alții în această privință și e important să interpretăm un pic câteva tehnici și rezultate aparent paradoxale.
Probabil cea mai șocantă idee de tratament a diabetului zaharat de tip doi e cu o dietă bogată în carbohidrați și în fibre. Cine e interesat de articol, aici sunt referințele și rezumatul.
https://pubmed.ncbi.nlm.nih.gov/495550/
High-carbohydrate, high-fiber diets for insulin-treated men with diabetes mellitus
J W Anderson, K Ward, PMID: 495550 DOI: 10.1093/ajcn/32.11.2312
Abstract
The effects of high-carbohydrate, high plant fiber (HCF) diets on glucose and lipid metabolism of 20 lean men receiving insulin therapy for diabetes mellitus were evaluated on a metabolic ward. All men received control diets for an average of 7 days followed by HCF diets for an average of 16 days. Diets were designed to be weight-maintaining and there were no significant alterations in body weight. The daily dose of insulin was lower for each patient on the HCF diet than on the control diet. The average insulin dose was reduced from 26 +/- 3 units/day (mean +/- SEM) on the control diets to 11 +/- 3 (P less than 0.001) on the HCF diets. On the HCF diets, insulin therapy could be discontinued in nine patients receiving 15 to 20 units/day and in two patients receiving 32 units/day. Fasting and 3-hr postprandial plasma glucose values were lower in most patients on the HCF diets than on the control diets despite lower insulin doses. Serum cholesterol values dropped from 206 +/- 10 mg/dl on the control diets to 147 +/- 5 (P less than 0.001) on the HCF diet; average fasting serum triglyceride values were not significantly altered on the HCF diets. These studies suggest that HCF diets may be the dietary therapy of choice for certain patients with the maturity-onset type of diabetes.
Nu îți spun toți doctorii că o dietă bogată ăn carbohidrați nu e potrivită pentru diabetici? Ei bine acest studiu ,,demonstrează” că poți consuma multe glucide, dar trebuie să le combini cu multe fibre alimentare.
Ei bine cineva să nu își închipuie că asemenea dietă se potrivește pentru oricine. Apoi, nu glucidele au îmbunățit situația diabeticilor în acest experiment ci cantitatea mare de fibre alimentare, iar acest aspect va fi analizat în detaliu mai tîrziu.
O dietă mai rațională și mai eficace necesită restricție la caloriile ingerate și următorul studiu din 1985 face exact așa ceva.
https://pubmed.ncbi.nlm.nih.gov/4044780/
Glycemic effects of intensive caloric restriction and isocaloric refeeding in noninsulin-dependent diabetes mellitus
R R Henry, L Scheaffer, J M Olefsky, PMID: 4044780 DOI: 10.1210/jcem-61-5-917
Abstract
To assess the effects of very low caloric (VLC) diets on glucose homeostasis in noninsulin-dependent diabetes mellitus, 30 obese subjects with NIDDM were studied for 40 days while eating a 330 Cal/day diet, with a subgroup of 12 subjects further evaluated during 40 days of refeeding. All subjects successfully lost weight, with an average weight loss of 4.6 +/- 0.2 kg (+/- SEM) after 10 days, 7.1 +/- 0.3 kg after 20 days, and 10.5 +/- 0.4 kg after 40 days of VLC diet therapy. Thus, weight loss was steady and progressive throughout the diet period. In contrast, the majority (87%) of the reduction in mean fasting plasma glucose (FPG) levels (297 +/- 13 to 158 +/- 10 mg/dl; P less than 0.001) occurred after 10 days of VLC diet therapy, with a further reduction in glucose levels to 138 +/- 9 mg/dl on day 40. The FPG response measured after 10 days of VLC diet was unrelated to the degree of obesity, rate or extent of weight loss, or prevailing insulin levels, but did correlate significantly with the initial FPG level (r = 0.37; P less than 0.05) and duration of diabetes (r = 0.42; P less than 0.05). After discontinuation of the VLC diet and refeeding of an isocaloric (weight maintenance) diet in 12 subjects, a variable increase in the FPG occurred, with an average increase of 80% after 40 days of refeeding. However, the mean FPG level after 40 days of refeeding was still markedly lower than that before VLC diet therapy (254 +/- 20 vs. 167 +/- 14 mg/dl; P less than 0.02) despite withdrawal of antidiabetic medication in all subjects. The basal hepatic glucose output (HGO) fell rapidly from 149 +/- 13 to 81 +/- 5 mg/M2 X min (P less than 0.001) after 10 days of VLC diet and rose from 67 +/- 4 to 88 +/- 7 mg/M2 X min (P less than 0.001) after 10 days of refeeding. Basal HGO demonstrated a highly significant positive correlation with FPG levels (r = 0.89; P less than 0.001) before and during both VLC diet therapy and refeeding. A significant correlation was also found between the change in FPG level and the change in basal HGO (r = 0.84; P less than 0.001) during both VLC diet and refeeding. Compared to that before the VLC diet, glucose tolerance to mixed meals was markedly improved during the refeeding period, with no change in circulating insulin levels.
Rezultatele acestui studiu sunt remarcabile, dar și restricțiile sunt la fel....
30 obezi diabetici au fost puși la o dietă de 300 calorii pe zi. Asta înseamnă că masa lor pe o zi era fie un corn cu un pahar cu lapte fie o farfurie cu niște conopidă fiartă. Cred că și în lagărele de concentrare meniul era de peste 500 calorii pe zi. Regimul administrat însemna o restricție la numărul de calorii totale și desigur că implicit toate categoriile de macronutrienți (proteine, lipide, glucide) au fost reduse la un minim de subzistență.
Aceasta este ,,calea justă” de a încerca remisia diabetului zaharat de tip 2, însă puține persoane rezistă ,,psihologic și fizic” la asemenea regim.
Toți subiecții au pierdut în greutate circa 4 Kg după 10 zile, circa 7,1 kg după 20 zile și circa 10,5 Kg după 40 zile iar scăderea în greutate a fost uniformă. În contrast, scăderea de glicemie cea mai mare se observă în primele 10 zile, de la 297 +/- 13 la 158 +/- 10 mg/dl, iar apoi o scădere mult mai lentă până la 138 +/- 9 mg/dl în 40 zile.
După întreruperea dietei, la 12 subiecți, a apărut o creștere glicemiei bazale, cu aproximativ 80% după 40 de zile de realimentare. Cu toate acestea, nivelul mediu al glicemiei bazale după 40 de zile de realimentare a fost încă semnificativ mai mic decât cel dinaintea dietei.
Presupun că nu multe persoane ar fi tentate să urmeze asemenea regim ,,eroic”, așa că e bine să mai vedem alte situații.
Un studiu recent (2019) arată că dacă grăsimea din ficat și pancreas este eliminată, există mari șanse ca diabetul să intre ăn remisie, chiar dacă corpul are încă cantități mari de lipide la purtător. Aici e referința la acest studiu și rezumatul:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6399621/
Calorie restriction for long-term remission of type 2 diabetes
Roy Taylor, Clin Med (Lond). 2019 Jan; 19(1): 37–42. doi: 10.7861/clinmedicine.19-1-37
ABSTRACT
Starting with a hypothesis which postulated a simple explanation arising from the basic cause of type 2 diabetes, a series of studies has introduced a paradigm shift in our understanding of the condition. Gradual accumulation of fat in the liver and pancreas leads eventually to beta cell dedifferentiation and loss of specialised function. The consequent hyperglycaemia can be returned to normal by removing the excess fat from liver and pancreas. At present this can be achieved only by substantial weight loss, and a simple practical and efficacious method for this has been developed and applied in a series of studies. For those people who used to have type 2 diabetes, the state of post-diabetes can be long term provided that weight regain is avoided. The implications for personal health and for national health economics are considerable.
În internet există multe materiale despre o anumită mișcare ,,low carb. high fat diet”. Personal nu consider că organismul uman e adaptat să urmeze o asemenea dietă pe termen lung. Pe termen scurt este tolerabilă, mai ales că are anumite benefice imediate: scădere în greutate fără efort, control al glicemiei prandiale, conveniența de avea tot timpul o masă care te așteaptă la orice fastfood de la colțul străzii, etc.
REGIMUL PROPUS PENTRU REMISIA DIABETULUI DE TIP 2
În mod normal nu imi place termenul regim, și ar fi mai justificat termenul stil de viață. De fapt oricine va descoperi că ,,regimul” pentru un diabetic e în fapt un stil de viată a unei persoane sănătoase cu câteva restricții până organismul revine la normalitate.
În acest stil de viață componentele principale care trebuiesc controlate sunt alimentația, efortul fizic, expunerea la soare, somnul și postul alimentar.
O primă regulă de bază e că trebuie să înveți să îți pregătești singur mâncarea iar ceea ce pregătești să fie bazat pe plante în proporție de cel puțin 80% iar restul de maxim 20 % produse animaliere. Dacă poți, pentru o perioadă de o săpămână testează o alimentație bazată doar pe plante sau derivate din plante.
Carnea, brânzeturile și alte produse animaliere trebuie să devină condimente pentru masa ta și nu baza alimentației tale.
Toată ambianța modernă te îndeamnă să mănânci cât mai mult și preferențial anumite alimente, iar fiecare justifică aceasta pe baza unor proprietăți miraculoase, etc, dar acestea sunt doar informații care îți spală creierul. Umanitatea a existat mai înainte ca niște firme să descopere alimentele ,,minune” și va continua să existe după ce aceste firme dispar.....
Organismul uman e perfect adaptat să lucreze mai bine când alimentația este moderată sau chiar ușor subcalorică decât atunci când are excess de alimente. Desigur că din această discuție se exclud copii sau gravidele pentru că acolo există un necesar de alimente mai mare și cât mai variat.
Nu sunt un adept al contabilizării caloriilor, și probabil în curând nu vei fi nici tu pentru că dacă ai o alimentație sănătoasă, a număra caloriile ingerate ar fi ultima ta grijă ...
Ca idee, dacă tot s-a ajuns la a discuta despre calorii, cred că minimul zilnic e un pic exagerat în datele oficiale. Dacă în Statele Unite, acum mai bine de jumătate de secol, lumea trăia bine și fără epidemii de boli cu circa 800 calorii pe zi mai puțin, nu crezi că asemenea profil ar fi valabil și pentru tine? Nu am informații despre România acelor vremuri așa că ....
Desigur nu e nevoie să ,,te chinui”pentru a reduce caloriile din alimentația ta.
Imediat ce îți pregătești singur hrana, și eviți semipreparatele sau preparatele din supermarket, atunci meniul tău se va adapta de la sine la o cantitate de calorii mai mică.
Dacă mâncarea care o prepari nu e gustoasă, deja ești pe calea cea bună în a grăbi procesul de vindecare a organismului....
Gândește-te că cel puțin o primă săptămână va fi groaznică până ce organismul se adaptează la noul stil...
Este important să consideri fibrele alimentare ca a patra categorie de macronutrienți absolut necesară alimentației tale.
În fapt dieta de bază pentru diabetic trebuie să fie una bogată în fibre alimentare și moderată în glucide, lipide și proteine.
Desigur că pot exista variații în acest cadru general și pe locul doi după fibre poți alege să fie glucidele sau lipidele ca și procentaj, iar rezultatele sunt aceleași.
Din punct de vedere al pacientului cred că având pe locul doi lipidele e mai ușor de suportat pentru cele mai multe persoane din motive care le-am explicat în partea I a acestui articol.
Nu îți imagina că dacă ai ales ca pe locul doi după fibre să fie lipidele de acum îți vei îmbăia alimentele în ulei sau grăsime.
Evită consumul exagerat de grăsimi chiar și dacă acestea sunt uleiuri vegetale. Uleiurile vegetale obișnuite (floarea soarelui, porumb. soia) conțin o proporție mare de omega-6 și puține omega-3. Excesul de omega-6 face ca acestea să împiedice metabolizarea omega-3 și asta perturbă întreg metabolismul lipidelor. Este recomandat să consumi semințe de in sau chia zilnic pentru a avea o sursă de omega-3 care să compensze excesul de omega-6. Suplimentele de omega-3 din pește sau alte surse sunt discutabile pentru că omeaga-3 sunt sensibili și în contact cu aerul sau după extracție și purificare râncezesc.
Ideal ar fi ca pentru o lună să nu consumi mai mult de 1 l ulei de măsline, 1 kg untură și 1 kg smântână.
Dacă ai ales lipide pe locul doi, atunci ai voie la câteva kg de semințe de in sau chia pe lună...
Suplimentezi aceste lipide cu ceva fructe ca avocado, nucă de cocos, etc în moderație. .
Excesul de proteine, în special cel de origine animală e dăunător pentru organism.
Prin consumarea de legume în mod regulat, automat asiguri cel puțin 8% din meniu să fie proteine. Ciuperci la discreție mai ales dacă sunt de pădure! Poți utiliza soia sub formă fermentată tofu, tempeh, miso în doze moderate.
Urzica nu e doar bogată în fibre ci are și toți aminoacizii esențiali deși în toate cărțile e scris că o plantă nu îndeplinește așa condiție!
Am să revin într-un alt articol cu o discuție detaliată despre ,,Cina Study” unde se demonstrează că proteinele animale în exces sunt cancerigene. Nu e nostim că alții cheltuiesc miliarde ca să afle sursa cancerului în organism?
Expunerea la soare e foarte importantă pentru organism pentru că cel puțin 5% din procesele biochimice sunt controlate de vitamina D; sunt sigur că în curând vor reveni și se vor mai găsi alte procese suplimentare controlate de acest compus. Evită orele de vărf, evită loțiunile contra radiației UV și urmează un proces de adaptare a organismului la timpi mai îndelungați de expunere.
În fiecare zi câte 5-10 minute cu creștere progresivă pe măsură ce te adaptezi, e mult mai bine decât o oră pe săptămână.